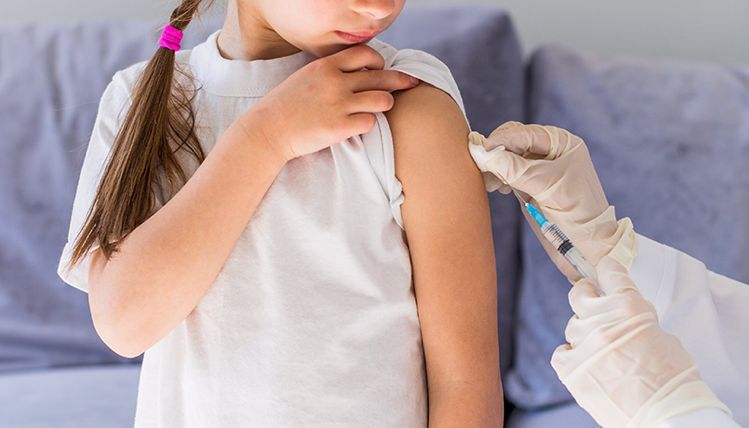
A vacinação de crianças entre 5 e 11 anos contra a Covid-19 está prevista para começar em janeiro de 2022, com diversas recomendações da Anvisa a serem seguidas. A princípio somente a vacina Pfizer poderá ser utilizado para esse público.
A Anvisa definiu 17 orientações para que a imunização ocorra com o mínimo de intercorrências. O comunicado foi publicado no último dia 16. Especialistas ressaltam a importância dos protocolos e que parte das medidas são de complexa execução e podem dificultar a vacinação, devido à falta de estrutura em algumas localidades.
O Ministério da Saúde orienta a inclusão da vacinação de crianças de 5 a 11 anos no Plano Nacional de Operacionalização das Vacinas Contra a Covid-19.
Veja as 17 recomendações da Anvisa:
1. Que a vacinação das crianças nessa faixa etária seja iniciada após treinamento completo das equipes de saúde que farão a aplicação, uma vez que a grande maioria dos eventos adversos pós-vacinação é decorrente da administração do produto errado à faixa etária, da dose inadequada e da preparação errônea do produto;
2. Que a imunização de crianças seja realizada em ambiente específico e segregado da vacinação de adultos, em ambiente acolhedor e seguro para a população;
3. Quando da vacinação nas comunidades isoladas, por exemplo nas aldeias indígenas, sempre que possível, que a imunização de crianças seja feita em dias separados, não coincidentes com a de adultos;
4. Que a sala em que se dará a aplicação de vacinas contra a Covid-19, em crianças de 5 a 11 anos, seja exclusiva para essa vacina, não sendo aproveitada para a aplicação de outras vacinas, ainda que pediátricas. Não havendo disponibilidade de infraestrutura para essa separação, que sejam adotadas todas as medidas para evitar erros de vacinação;
5. Que a vacina Covid-19 não seja administrada de forma concomitante a outras vacinas do calendário infantil, por precaução, sendo recomendado um intervalo de 15 dias;
6. Que seja evitada a vacinação das crianças de 5 a 11 anos em postos de vacinação na modalidade drive-thru;
7. Que as crianças sejam acolhidas e permaneçam no local em que a vacinação ocorrer por pelo menos 20 minutos após a aplicação, facilitando que sejam observadas durante esse breve período;
8. Que os profissionais de saúde, antes de aplicarem a vacina, informem ao responsável que acompanha a criança sobre os principais sintomas locais esperados (por exemplo, dor, inchaço,vermelhidão no local da injeção) e sistêmico (por exemplo, febre, fadiga, dor de cabeça, calafrios, mialgia, artralgia) outras reações após vacinação, como linfadenopatia axilar localizada no mesmo lado do braço vacinado foi observada após vacinação com vacinas de mRNA COVID-19;
9. Que os pais ou responsáveis sejam orientados a procurar o médico se a criança apresentar dores repentinas no peito, falta de ar ou palpitações após a aplicação da vacina;
10. Que os profissionais de saúde, antes de aplicarem a vacina, mostrem ao responsável que acompanha a criança que se trata da vacina contra a COVID-19, frasco na cor laranja, cuja dose de 0,2ml, contendo 10 mcg da vacina contra a COVID-19, Comirnaty (Pfizer/Wyeth), específica para crianças entre 5 a 11 anos, bem como seja mostrado a seringa a ser utilizada (1 mL) e o volume a ser aplicado (0,2mL);
11. Que um plano de comunicação sobre essas diferenças de cor entre os produtos, incluindo a utilização de redes sociais e estratégias mais visuais que textuais, seja implementado;
12. Que seja considerada a possibilidade de avaliação da existência de frascos de outras vacinas semelhantes no mercado, que sejam administradas dentro do calendário vacinal infantil, e que possam gerar trocas ou erros de administração;
13. Que as crianças que completarem 12 anos entre a primeira e a segunda dose, permaneçam com a dose pediátrica da vacina Comirnaty;
14. Que os centros/postos de saúde e hospitais infantis estejam atentos e treinados para atender e captar eventuais reações adversar em crianças de 5 a 11 anos, após tomarem a vacina;
15. Que seja adotado um programa de monitoramento, capaz de captar os sinais de interesse da farmacovigilância;
16. Que sejam mantidos os estudos de efetividade das vacinas para a faixa etária de 5 a 11 anos e
17. Adoção de outras ações de proteção e segurança para a vacinação das crianças, a critério do Ministério da Saúde e dos demais gestores da saúde pública.